|
|||
|
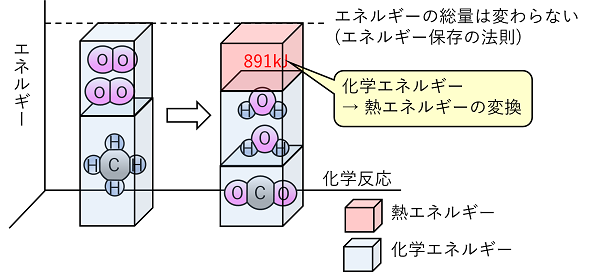
4化学反応と光エネルギー 1 エネルギーの変換と保存 【化学エネルギー】 物質が他の物質を動かしたり,変形させたりする(仕事をする)能力をエネルギーという。エネルギーの単位は仕事(力×距離 ⇒ W〔J〕=F〔N〕s〔m〕)と同じJ(ジュール)となる。1Jは,物質が1Nの力を受け,力の方向に1m移動しときに受ける仕事である。 エネルギーはその保存形態・移動形態がさまざまであり,力学的・熱・光・電気・核・化学エネルギーなどがある。 化学物質が化学反応を起こすと熱などのエネルギーが放出または吸収される。これは,化学物質はそれぞれ固有のエネルギーをもっているためであり,これを〔 化学エネルギー 〕という。 |
|||
|
【エネルギーの変換と保存】 各種のエネルギーは互いに別のエネルギーに変換される。例えば,化学反応によって生じた反応物の化学エネルギーの総和と反応物の化学エネルギーの総和の差は,熱・電気・光エネルギーとして放出または吸収される。このようにエネルギーが別のエネルギーに変わることをエネルギーの変換という。 エネルギーの変換に関して,変換効率とエネルギー保存の法則を次にまとめておく。 ・変換効率 あるエネルギーをすべて別の特定のエネルギー変換することは困難である。あるエネルギーが特定のエネルギーにどれだけ変換されたか表す比率を変換効率という。 ・エネルギー保存の法則 エネルギーの変換が起こっても,その前後でエネルギーの総量は変わらない。これをエネルギー保存の法則という。 |
|||
|
|
|||
|
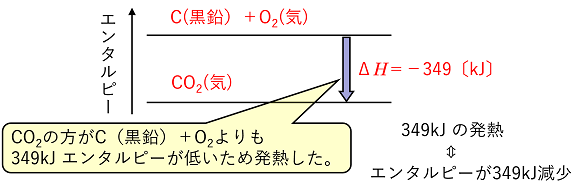
【エンタルピーH】 熱力学においてエネルギーの状態を示す量(単位はJ)を〔 エンタルピー 〕といい,Hの記号で示す。高エネルギーの状態はHが大きく,低エネルギー状態はHが小さい。そのため,反応による発熱や吸熱の量は反応前後のエンタルピーの差ΔHとなる。 〈参考〉観測者が着目している部分を系という。また,系がもつ全エネルギーを内部エネルギーUという。フラスコ内の気 体や試験管内の溶液などの物質は系と考えることができる。系のエネルギーの状態は系の内部エネルギーU〔J〕と系が行う体積変化(膨張)の仕事(圧力P×体積V )〔J〕によって決まる。そこで,H=U+PVと定義し,系のエネルギー状態を示す量としている。圧力が一定のもとでは,PVの変化がないので,Hは物質がもつエネルギーといえる。 |
|||
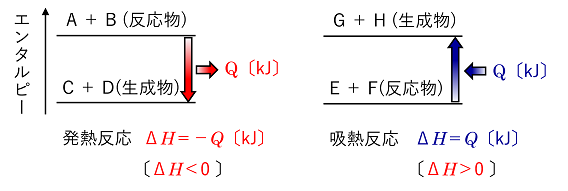
例のように熱エネルギーが放出される反応を〔 発熱反応 〕という。また,熱エネルギーが吸収される反応を〔 吸熱反応 〕という。 |
|||
| 【反応熱】
化学反応にともなって放出または吸収される熱を〔 反応熱 〕という。反応熱は,反応物のエンタルピーの総和と生成物のエンタルピーの総和の差となる。そのため,反応熱は反応エンタルピーともいい,反応前後でのエンタルピー変化ΔH (=H(生成物)-H(反応物))で表される。発熱反応と吸熱反応ではΔHは次のようになる。
吸熱反応:「反応物のエンタルピーの総和 < 生成物のエンタルピーの総和」の場合の化学変化で,〔 ΔH > 0 〕になる。 |
|||
 |
|||
|
【反応熱の表し方】 反応熱はエンタルピー変化ΔHと化学反応式で表す。その際,着目する物質の係数が1になるように反応式をつくる(他の物質の係数が分数になっても構わない)。また,物質の状態によって反応熱は変わるので,化学反応式の各物質の化学式の後にその状態を( )で示す。(化学反応式にΔHを添付したものを熱化学方程式とよぶことがある) 例)「炭素C(黒鉛)1molを燃焼すると349kJの熱が発生する」この反応を化学反応式とΔHで表すと次のようになる。 |
|||
 |
|||
|
C(黒鉛) 1molなのでC(黒鉛)の係数を1にする。その結果,他の係数は分数になってもよい。O2やH2など常識的に気体であるような物質の状態は示さなくてもよい。H2Oは何も指示されなければH2O(液)とする。Cなど,同素体がある場合は,それを示す。その他は指示通りに示せばよい。 |
|||
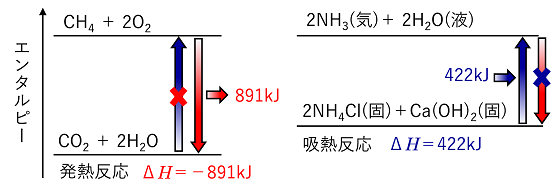
| 【反応熱の種類】 燃焼熱(燃焼エンタルピー) 物質1molが完全に燃焼するときに発生する熱(燃焼は発熱反応しかない)。 (燃焼:物質とO2が反応する。CとHからなる物質の場合,CO2とH2Oが生成する) 例)メタンCH4の燃焼エンタルピーは -890
kJ/molである。 CH41molあたりー890kJなので,CH4の係数を1にする。CH4の係数を1にするので「/mol」は不要 〔 CH4 + 2O2 → CO2 + 2H2O(液) ΔH=-890kJ 〕 例題 次の内容を化学反応式とエンタルピー変化ΔHで示せ。 (1) 水素H2の燃焼エンタルピーは-286kJ/molである。 (2) プロパンC3H8 1molを燃焼すると2219kJの熱を発生する。 (1) H2 + 1/2O2 → H2O(液) ΔH=-286kJ (2) C3H8 + 5O2 → 3CO2 + 4H2O(液) ΔH=-2219kJ
生成熱(生成エンタルピー) 化合物1molが,成分元素の単体から生成するときに発生または吸収する熱。 例)水H2O(液)の生成エンタルピーは
-286 kJ/molである。 H2O(液)の成分元素はHとOなので,HとOの単体H2とO2でH2Oをつくる。H2O(液)の係数を1にするので「/mol」は不要。 〔 H2 + 1/2O2 → H2O(液) ΔH=-286kJ 〕 例題 次の内容を化学反応式とエンタルピー変化ΔHで示せ。 (1) アンモニアNH3の生成エンタルピーは-45.9kJ/molである。 (2) エタノールC2H5OH(液)の生成エンタルピーは -277 kJ/molである。 (3) エチレンC2H4の生成エンタルピーは52.5kJ/molである。 (1) 1/2N2 + 3/2H2 → NH3 ΔH=-45.9kJ (2) 2C(黒鉛) + 1/2O2 + 3H2 → C2H5OH(液) ΔH=-277kJ 通常,Cは(黒鉛)とする。 (3) 2C(黒鉛) + 2H2 → C2H4 ΔH=52.5kJ 溶解熱(溶解エンタルピー) 物質1molを多量の溶媒に溶かしたときに発生または吸収する熱。 例)塩化ナトリウムNaClの水に対する溶解エンタルピーは3.88kJ/molである。 「多量の水に溶かす」は,+aqとする。「塩化ナトリウム水溶液」はNaClaqとする。aqはaqua(水,水溶液の意味)NaClの係数を1にするので「/mol」は不要。 〔 NaCl + aq → NaClaq ΔH=3.88kJ 〕 例題 次の内容を化学反応式とエンタルピー変化ΔHで示せ。 (1) 硫酸H2SO4の溶解エンタルピーは-95.3 kJ/molである。 (2) エタノールC2H5OH(液) 1molを水に溶解すると,10.5kJの熱が吸収される (1) H2SO4 + aq → H2SO4aq ΔH=-95.3kJ (2) C2H5OH(液) + aq → C2H5OHaq ΔH=10.5kJ 中和熱(中和エンタルピー) 酸が出すH+と塩基が出すOH-が反応してH2Oが生成するときに発生する熱。(H2O
1molあたり56.5kJの発熱 ⇒ 1価の酸と1価の塩基の中和エンタルピーは-56.5kJ) HClaq + NaOHaq → NaClaq + H2O(液) ΔH=-56.5kJ (H+aq + OH-aq → H2O(液) ΔH=-56.5kJ) |
|||
|
|||
|
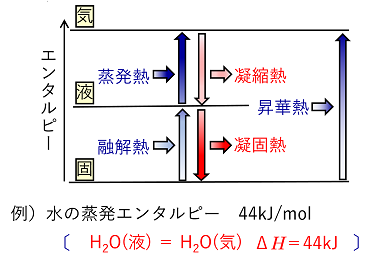
例題 25℃,1013hPaのもとで水の蒸発と凝縮で出入りする熱は,どちらも44kJ/molである。また,水の凝固エンタルピーは25℃,1013hPaで-6.0kJ/molである。 (1) 水の蒸発と凝縮を反応式とΔHを用いてそれぞれ記せ。 (2)
(1)で一方が吸熱変化,他方が発熱変化になる理由を,分子の熱運動のちがいと,気体と液体のもつエネルギーの差に着目して説明せよ。 (3) 0℃の氷180gをすべて100℃の水蒸気にするのに必要な熱量は何kJか。ただし,水 の比熱を4.2J/(g·K)とする。H=1.0 O=16 (1) 蒸発:H2O(液) → H2O(気) ΔH=44kJ 凝縮:H2O(気) → H2O(液) ΔH=-44kJ ⑵
気体は液体に比べて分子の熱運動が激しく,分子のもつエネルギーが大きい。そのエネルギーの差が,蒸発では吸熱,凝縮では発熱となってあらわれるため (3) 180/18×6.0 + 180×4.2×100×10-3 + 180/18×44 = 575.6 ≒ 5.8×102kJ 例題 次の反応熱について答えよ。ただし,水の比熱は4.2J/(g・K)とする。 CH4 + 2O2
→ CO2 + 2H2O(液) ΔH=-891kJ (1) 標準状態で112LのメタンCH4を完全燃焼するとき,発生する熱量は何kJか。 (2) 25℃の水5.0kgを100℃にするには,メタンを何mol燃焼させればよいか。 (1) 4.46×103kJ (2) 1.8mol
|
|||
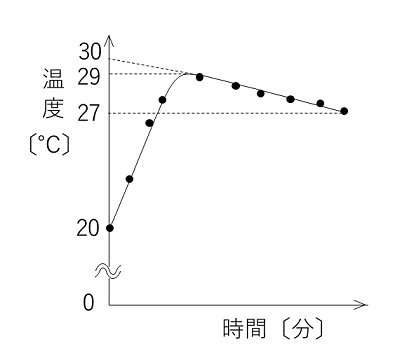
| 例題 大型試験管に水50gを入れ,すばやくはかりとった固体の水酸化ナトリウム2.0gを加えてよくかき混ぜ,温度変化を調べた。図は,水溶液の温度を,混合の瞬間から時間とともに記録したものである。下の各問いに答えよ。ただし,水溶液の比熱は4.2J/(g・K)とする。H=1.0,O=16,Na=23 |
|||
|
|||
|
【自発的に進む反応】 自発的に進む反応とΔH 反応には自発的に進むものと,進まないものがある。自発的に進む反応は圧倒的に 〔 発熱反応 〕が多い。そのため〔
ΔH<0 〕である反応は自発的に進みやすいといえる。しかし,自発的に進む吸熱反応もあり,ΔH以外の要因もあることがわかる。 |
|||
 |
|||
|
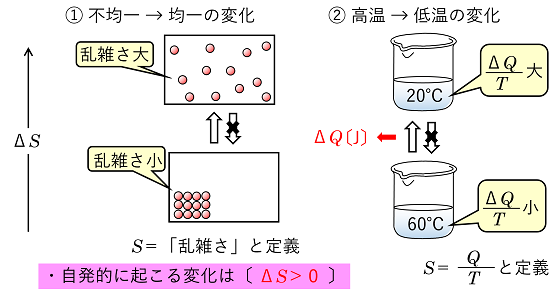
エントロピー変化ΔS 自発的に起こる変化について,どのような量が変化するか,次の二つの変化で考える。 ➀ 不均一な状態は均一な状態になる(拡散する) ②
暖かいものは冷める この変化では,何かの量が変化(増加)しているはずで,この量を〔 エントロピー 〕とよび,記号Sで表す。エントロピーは様々な分野で定義されている。 |
|||
 |
|||
|
➀の変化は統計力学によるもので,「乱雑さ」が増大しているので,Sは「乱雑さ」と定義されている。②の変化は熱力学によるもので,実験的にQ/Tが増加することが分かっている。そこで,S=Q/T〔J/K〕と定義されている。いずれも〔 ΔS>0 〕である反応は自発的に進みやすいといえる。 |
|||
|
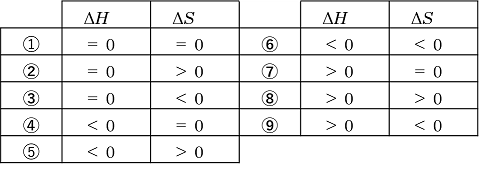
自発的に進む反応 ア)ΔH<0,ΔS>0 ⇔ 自発的に反応が進む (発熱して乱雑さが増加) イ)ΔH>0,ΔS>0 ⇔ 高温条件で自発的に反応が進む
(吸熱して乱雑さが増加) ウ)ΔH<0,ΔS<0 ⇔ 低温条件で自発的に反応が進む (発熱して乱雑さが減少) エ)ΔH>0,ΔS<0 ⇔ 自発的には反応が進まない
〈参考〉 自由エネルギー変化ΔGは,ΔG=ΔH-TΔSと定義され,ΔG<0の反応は自発的に起こることが分かっている。 上のイ),ウ)の条件はΔGの式から判断できる。 |
|||
(1) ② (2) ⑧ (3) ⑥ (4) ⑥ |
|||
|
例題 次の記述のうち,正しいものをすべて選べ。 (ア) 大きい吸熱を伴う反応は,自然に進行しやすい。 (イ) 発熱反応では,物質の持つエンタルピーは減少する。 (ウ) Fe2O3の生成エンタルピーは-822kJ/molである。鉄は乾いた空気中で酸化されFe2O3になる。このとき,まわりから熱を吸収する。 (エ) エントロピーの増大,すなわち乱雑さが増す反応は,自然に進行しやすい。 (オ) 2molの水素と1molの酸素から液体の水2molが生成する反応エンタルピーは,気体の水2molが生成するときの反応エンタルピーよりも,その絶対値は小さい。 (イ),(エ) |
|||
|
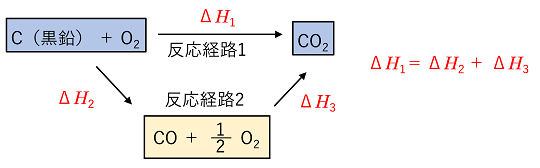
【ヘスの法則(総熱量保存の法則)】 「化学反応において,反応物質と生成物質とが同じであれば,途中の反応経路に関係なく,発生または吸収される熱量(反応熱=ΔH)は一定である。」 |
|||
 |
|||
|
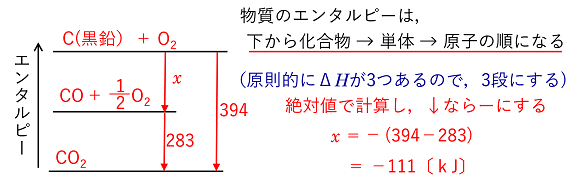
例)つぎの反応式の反応エンタルピーのx[kJ]の値を,①,②の反応式から求める。 C(黒鉛) + 1/2O2 → CO ΔH=x
kJ C(黒鉛) + O2 → CO2 ΔH=-394 kJ ・・・ ① CO + 1/2O2 → CO2 ΔH=-283 kJ ・・・ ② |
|||
| (解法1)①,②を連立させてxを含む式をつくる。この場合,①-②でできる。 |
|||
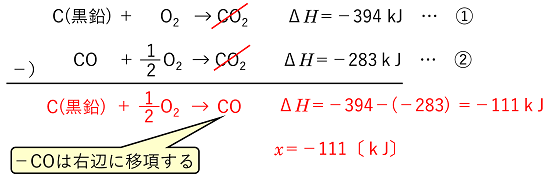 |
|||
(解法2)エネルギー図にする。(原則的に,ΔHが3つあるので3段にする) |
|||
 |
|||
|
例題 次の反応式の反応エンタルピーΔHの値を下の①~③の反応式を用いて求めよ。 C(黒鉛) +
2H2 → CH4 ΔH=x
kJ CH4 + 2O2
→ CO2 + 2H2O(液) ΔH=-891kJ ・・・ ① C(黒鉛)+ O2 → CO2 ΔH=-394kJ ・・・ ② 2H2 + O2 → 2H2O(液) ΔH=-572 kJ ・・・ ③ ②+③-① -75kJ 例題 次の①~④の反応式を用いて,下の各問いに答えよ。 H=1.0 O=16 H2 + 1/2O2 →
H2O(液) ΔH=-286kJ ・・・
① H2 + 1/2O2 →
H2O(気) ΔH=-242 kJ ・・・ ② C(黒鉛) +
O2 → CO2 ΔH=-394kJ ・・・
③ CH3OH(液) + 3/2O2
→ CO2 + 2H2O(液) ΔH=-726kJ ・・・ ④ (1) 水の蒸発エンタルピーは,1gあたり何kJか。 (2) メタノール(液)の生成エンタルピーは何kJ/molか。 (1) 2.4kJ (2) -240kJ/mol 生成熱と反応熱(エンタルピー変化) 「反応エンタルピー = (生成物の生成エンタルピーの総和)-(反応物の生成エンタルピーの総和)」が成立する。 (生成エンタルピー:化合物1molが,成分元素の単体から生成するときのエンタルピー変化) 例題 (1) エタノールC2H5OH(液),二酸化炭素CO2および水H2O(液)の生成エンタルピーは,それぞれ-277kJ/mol,-394kJ/molおよび-286kJ/molである。エタノールC2H5OH(液)の燃焼エンタルピーを求めよ。 エタノールの燃焼 C2H5OH(液) + 3O2 → 2CO2 + 3H2O(液) ΔH=x kJ x ={(-394×2)➀+(-286×3②)}-(-277③ + 0④) = -1369〔kJ/mol〕 ➀ CO2の生成エンタルピー×2 ② H2O(液)の生成エンタルピー×3 ③ C2H5OH(液)の生成エンタルピー ④ 単体の生成熱は0 (2) 炭素(黒鉛)および水素H2の燃焼エンタルピーは,それぞれ-394kJ/mol,-286kJ/molである。また,プロパンC3H8の生成エンタルピーは,-103kJ/molである。プロパンC3H8の燃焼エンタルピーを求めよ。 黒鉛の燃焼 C(黒鉛) + O2 → CO2 ΔH=-394kJ ⇒CO2の生成エンタルピーでもある 水素の燃焼 H2 + 1/2O2 → H2O(液) ΔH=-289kJ ⇒ H2O(液)の生成エンタルピーでもある プロパンの燃焼 C3H8 + 5O2 → 3CO2 + 4H2O(液) ΔH=x kJ x ={-394×3 + (-286×4)}- (-103 + 0)= -2223〔kJ/mol〕 |
|||
|
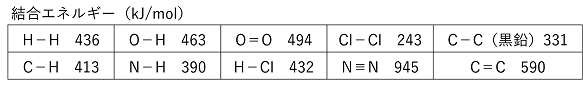
【結合エネルギーと反応熱(エンタルピー変化)】 結合エネルギー(結合エンタルピー) 原子間の共有結合を切り,ばらばらの原子にするのに必要な,結合1molあたりのエネルギーを結合エネルギーという。 |
|||
 |
|||
|
例)H-Hの結合エネルギー 436kJ/mol H2分子のH-H結合を切って,水素原子2Hにするのに必要なエネルギーが1molあたり432kJである。 この変化を化学反応式とΔHで示すなら, H2 → 2H ΔH=436 kJ |
|||
|
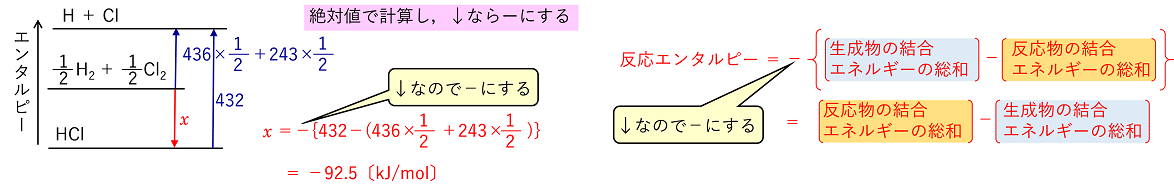
結合エネルギーとエンタルピー変化 分子を構成している分子間の結合エネルギーが分かっていると,気体状態において分子が反応するときの反応熱を求めることができる。 例)HClの生成エンタルピーを求める。 1/2H2 +
1/2Cl2 → HCl ΔH=x kJ |
|||
 |
|||
|
(解法2)次の関係式を利用する。 反応エンタルピー=(反応物の結合エネルギーの総和)-(生成物の結合エネルギーの総和) x = (436×1/2 + 243×1/2) -432= -92.5〔kJ/mol〕 |
|||
|
例題 (1) H2O(気)の生成エンタルピーを求めよ。ただし,H-H,H-O,O=Oの結合エネルギーをそれぞれ436,463,494 kJ/molとする。 (2) 次の反応式とΔHを用いて,N≡Nの結合エネルギーを求めよ。ただし,H-H,H-Nの結合エネルギーをそれぞれ436kJ/mol,391kJ/molとする。 N2 + 3H2 → 2NH3 ΔH=-92.2kJ (1) H2 + 1/2O2 → H2O(気) ΔH=x kJ ΔH=結合エネルギーの差(反応物-生成物)を利用 x = ( 436➀ +494×1/2②) - 463×2③ = -243〔kJ/mol〕 ➀ H-H ②
O=O×1/2 ③
H-O×2 (2) N≡Nをx kJ/molとする ΔH=結合エネルギーの差(反応物-生成物)を利用 -92.2 = ( x + 436×3 ) - 391×3× 2 x = 945.8 ≒
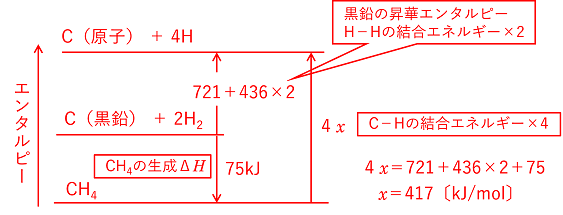
946〔kJ/mol〕 例題 メタンCH4の生成エンタルピーは-75kJ/mol,黒鉛Cの昇華エンタルピーは721kJ/mol,水素分子中のH-Hの結合エネルギーは436kJ/molである。CH4中のC-Hの結合エネルギーを求めよ。 |
|||
|
|||
|
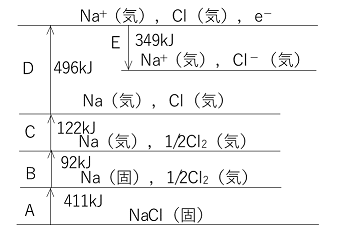
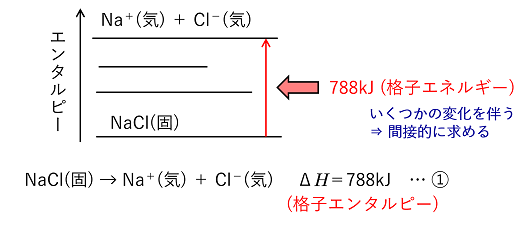
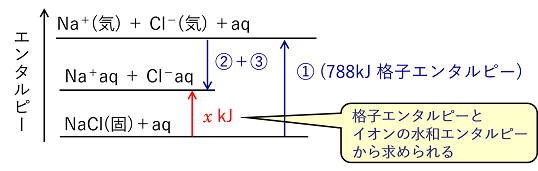
イオン結晶の格子エネルギー 1molのイオン結晶を気体状の陰イオンと陽イオンに分解するのに必要なエネルギーを格子エネルギーという。このときのエンタルピー変化を格子エンタルピーという。 例)NaCl(固)の格子エネルギーは788kJ/mol NaCl(固) → Na+(気) + Cl-(気) ΔH=788kJ … ① (格子エンタルピーは間接的に求めなければならず,後の例題のような格子エンタルピーを求める循環過程をボルン・ハーバーサイクルという。) |
|||
 |
|||
|
イオン結晶の溶解エンタルピー イオン結晶を溶解したときの溶解エンタルピーは,格子エンタルピーと生成したイオンの水和エンタルピーから求められる。 例) NaCl(固) + aq → Na+aq+ Cl-aq ΔH=x kJ Na+(気) + aq → Na+aq ΔH=-421kJ … ② Cl-(気) + aq → Cl-aq ΔH=-363kJ … ③ ①+②+③より, x=788-421-363=4〔kJ/mol〕 |
|||
 |
|||
|
|||
|
(1) A (2) Naの第一イオン化エネルギー Dでは,Cl(気)は変化していないので,Na(気) → Na+(気) + e- の変化 原子から電子を一つ取って陽イオンにするためにエネルギーに相当する。 (3) Cl(気) + e- → Cl-(気) ΔH=-349kJ Eでは,Na+(気)は変化していないのでClだけを考える。 (4)NaCl(固) → Na+(気) + Cl-(気) ΔH=772kJ |
|||
|
【光エネルギー】 光は〔 波 〕としての性質をもち,その波長により,電波,赤外線,可視光線,紫外線,X線などに分類されるが,これらを総称して電磁波という。光の波長λ〔m〕と振動数ν〔/s〕は互いに反比例の関係にあり,光の速度c〔m/s〕は,c=λνで表され一定となる。 また光は,〔 粒子 〕としての性質ももち,光の粒子を光子といい,光子のもつエネルギーE〔J〕はE=hν
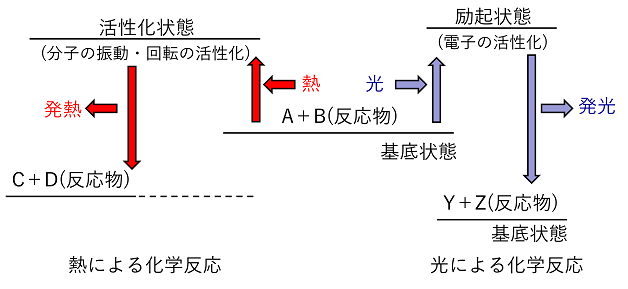
(hはプランク定数=6.63×10-34〔J·s〕)で表される。したがって,光のエネルギーは波長が短い(振動数が大きい)ものほど大きくなる。 【光エネルギーと化学反応】 反応物が熱エネルギーを吸収した場合と,光エネルギーを吸収した場合では,起こる反応が異なる(異なった生成物ができる)。化学反応では,反応物がエネルギーを吸収すると,一時的にエネルギー状態の高い(不安定な)活性化状態となってから生成物へ変化する。熱エネルギーを吸収した場合は,主に分子の振動・回転が活性化され反応が起こる。一方,光エネルギーを吸収した場合は,電子が活性化(例えばK殻の電子がL殻に移動)して反応が起こる。電子が活性化された状態を励起状態,エネルギーの低い状態を基底状態という。励起は熱エネルギーによっても起こり,これを熱励起という。 |
|||
 |
|||
|
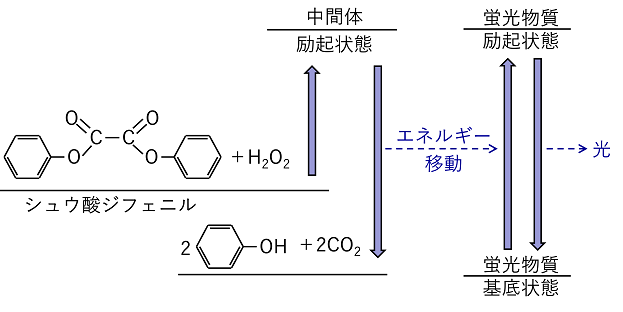
【化学発光】 発光には物体表面の熱エネルギーが光として放出する熱発光と,物質の化学変化によって光が放出される化学発光がある。 化学反応によっておこる発光を〔 化学発光 〕という。また生物体内で起こる化学変化による発光を〔 生物発光 〕という。化学発光は,励起状態の物質が生成して基底状態に変化したときに光が放出される。この原理での発生する光を蛍光という。 シュウ酸ジフェニル シュウ酸ジフェニルに蛍光物質を混合し,過酸化水素などを加えると,シュウ酸ジフェニルが分解する際,蛍光物質にエネルギーが与えられ蛍光が発生する。シュウ酸ジフェニルはケミカルライトに用いられる。 |
|||
 |
|||
|
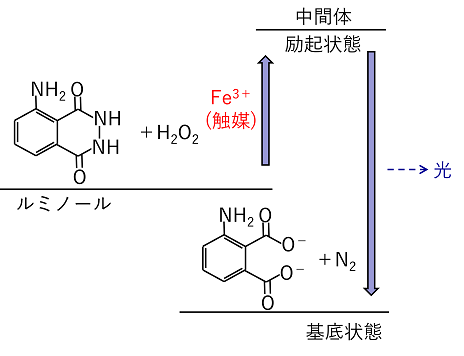
ルミノール 塩基性水溶液中でルミノールを過酸化水素などで酸化すると青く発色する。この反応には,鉄などの遷移金属およびその錯体が触媒となる。この反応をルミノール反応という。血液中のヘモグロビンには鉄の錯体が含まれているため,ルミノールと酸化剤の混合物に血液を加えた場合,発光が見られる。このため,ルミノール反応は血痕の鑑識などに利用される。 |
|||
 |
|||
|
ルシフェリン ホタルなどの発光を行う生物は,体内で起こる化学反応によって発光する。ホタルは体内にルシフェリンという有機化合物をもっており,これを酵素ルシフェラーゼによって酸化する。酸化の過程で,中間体(励起状態)ができ,酸化生成物(基底状態)になるときに発光する。 【光化学反応】 光エネルギーを吸収して起こる化学変化を光化学反応という。光エネルギーは物質の電子を活性化させ励起状態にする。そのため,かなり強い結合でも切断されるので,さまざまな分解反応が起こる。また,反応性に富んだラジカル(遊離基)を生成させ,反応が次々に進行する連鎖反応が起こる。ラジカルとは,共有結合が切れ不対電子をもった原子や原子団のことをいう。 |
|||
 |
|||
|
分解反応 硝酸HNO3,塩化銀AgClなどは光により分解する。 4HNO3 → 4NO2
+ 2H2O + O2
AgCl → Ag + Cl2 (ハロゲン化銀の感光性。臭化銀AgBrは写真のフィルムに利用) 光合成 植物は葉緑体内にある色素クロロフィルで光エネルギーを吸収してCO2とH2Oからデンプン(多数のグルコースC6H12O6が結合したもの)を合成する。CO2とH2OからC6H12O6が合成される場合,次の反応式ように表され,光エネルギーによる吸熱反応であることが分かる。 6CO2(気) + 6H2O(液) → C6H12O6(固) + 6O2(気) ΔH=2807kJ この反応過程で,起こる光化学反応はH2Oの分解である。このとき生成した物質とCO2からC6H12O6が合成される。 2H2O → O2
+ 4H+ + 4e- 連鎖反応 光を当てると瞬時に起こる反応がある。これは,生成したラジカルにより連鎖的に反応が進むからである。塩素Cl2と水素H2の混合気体に光を当てると,瞬時に塩化水素HClが生成する。 Cl2 + H2 → 2HCl |
|||
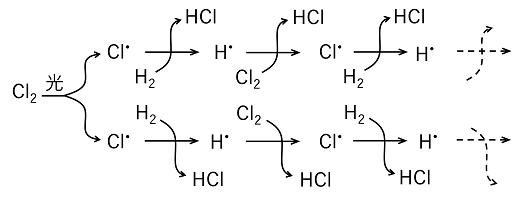 |
|||
|
オゾン層の分解: 排出されたフロン(CCl3Fなどのハロゲン原子を含んだ化合物)ガスが紫外線により分解し,生成したハロゲンのラジカルがオゾンO3と連鎖反応を起こし酸素O2に分解していく。 光化学オキシダント: 大気中の排出されたNO2などの窒素酸化物は,大気中の有機化合物と光化学反応(連鎖反応)を起こし,オゾンO3やその他の酸化性物(オキシダント)を生じる。これらの酸化性物質を光化学オキシダントという。光化学オキシダントは酸化作用が強く目や喉の粘膜を刺激する。光化学オキシダントと空気中の水分がらできた霧を光化学スモッグとう。 光触媒 光エネルギーによって化学反応を触媒する物質を光触媒という。代表的な光触媒に酸化チタン(Ⅳ)TiO2がある。光を吸収したTiO2は励起状態となり,いろいろな反応を触媒する。今日,TiO2を含んだ塗料やコーティングした素材が多く利用されている。 ➀ 本多・藤嶋効果 TiO2とPtを電極とし,水(または水溶液)に浸し,TiO2に紫外線を照射するとTiO2の表面は強い酸化力をもつようになり,水の電気分解のような反応が起こる。この現象を発見者にちなんで本多・藤嶋効果とよんでいる。 |
|||
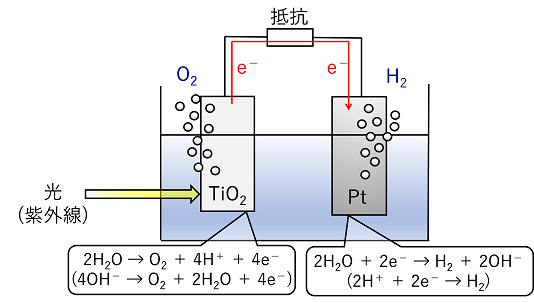 |
|||
|
② 光触媒の分解力 紫外線が照射されたTiO2の表面は,電子と電子が移動してできた部分(正孔という)が生じる。空気中の酸素は電子と,水は正孔と反応し活性酸素(·O2-や·OHなどの酸素のラジカルをもつ化合物)が生成する。この活性酸素を利用して汚れやバクテリアなど分解することができる。 |
|||
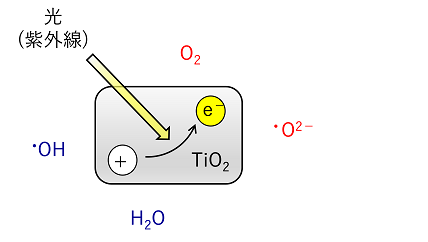 |
|||
|
③ 光触媒の親水性 水の中でTiO2に紫外線を照射するとTiとOの結合の一部が切れ,Oと水分子が反応して極性をもつOH(ヒドロキシ基)が形成される。そのため,親水性が高まる。ガラスなどに酸化チタンをコーティングすると,その表面に水をかけても薄い膜となって流れていくので,曇り止めなどに利用されている。 |
|||
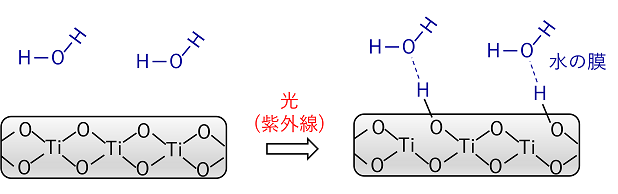 |
|||
 |